近日,CFDA起草了《化學藥品注冊分類改革工作方案(征求意見稿)》,與《藥品注冊管理辦法》(2007版)相比,到底有哪些不同,有哪些看點?
2015年11月6日,為貫徹落實《國務院關于改革藥品醫療器審評審批制度的意見》(國發〔2015〕44 號)提出的開展藥品上市許可持有人制度試點工作及改革藥品注冊分類工作的相關要求,食品藥品監管總局起草了《藥品上市許可持有人制度試點方案(征求意見稿)》和《化學藥品注冊分類改革工作方案(征求意見稿)》。修改意見于2015年11月20日前通過電子郵件反饋至食品藥品監管總局。
一,化藥的定義改變確定
征求意見稿:根據藥品的安全風險程度,將藥品分為新藥和仿制藥兩大類;其次,根據藥品原創性和新穎性的不同,將新藥進一步分為創新藥和改良型新藥;第三,在仿制藥中,根據被仿制藥上市情況不同,進一步細分為對境外上市、境內未上市藥品的仿制,對境內上市藥品的仿制以及境外上市藥品申請境內上市三類。新藥是指未在中國境內外上市銷售的藥品,將境外上市境內未上市藥品納入仿制藥。
《藥品注冊管理辦法》(2007版):藥品注冊申請包括新藥申請、仿制藥申請、進口藥品申請及其補充申請和再注冊申請。新藥申請,是指未曾在中國境內上市銷售的藥品的注冊申請。對已上市藥品改變劑型、改變給藥途徑、增加新適應癥的藥品注冊按照新藥申請的程序申報。仿制藥申請,是指生產國家食品藥品監督管理局已批準上市的已有國家標準的藥品的注冊申請。
二、化藥分類與新藥監測期變化
化藥分類方面,新增了“2.5類含有已知活性成份的新用法用量和新規格的制劑”。
新藥監測期方面,2.4類“含有已知活性成份的新適應癥的制劑”以往沒有新藥監測期,征求意見稿對新藥監測期為3年,新增2.5類“含有已知活性成份的新用法用量和新規格的制劑”新藥監測期也為3年。07年版《藥品注冊管理辦法》中化學藥品3.1類、3.2類和3.3類有相應的新藥監測期,但是按照征求意見稿合并進新3類“仿制境外上市、境內未上市的藥品”后并無新藥監測期。
本次分類征求意見稿沒有提及首仿藥獨占期。
表1 征求意見稿化學注冊新分類和2007年版《藥品注冊管理辦法》對比 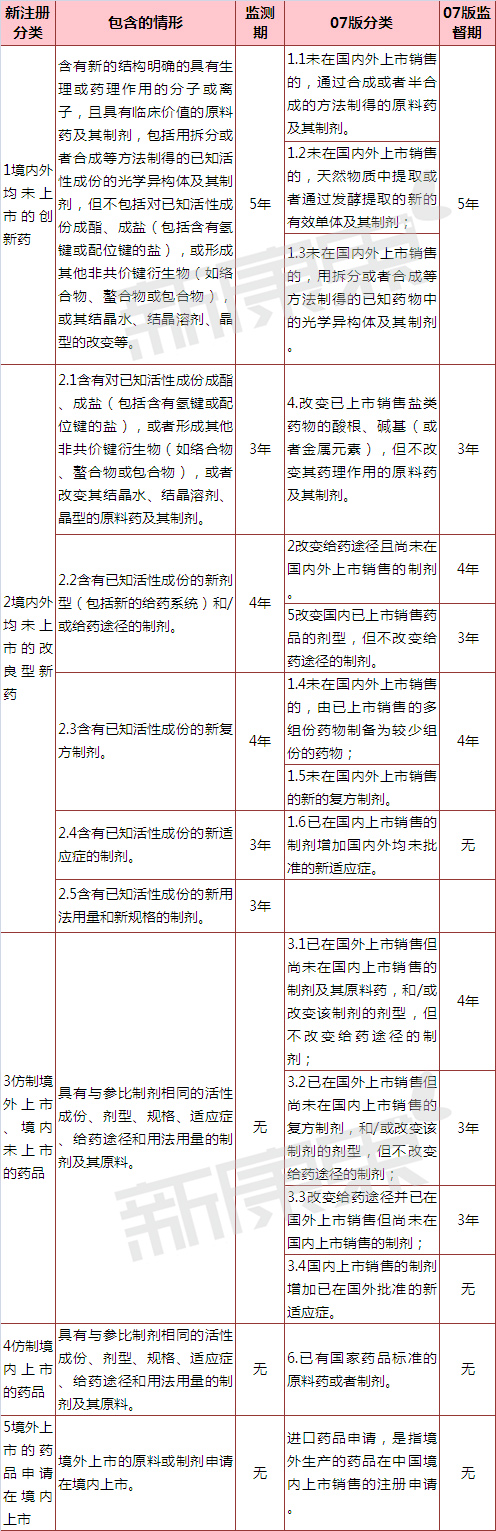 注:此分類對應只是個人初判,一切最終分類以國家局為準。
三、化學藥品新注冊分類申報資料更注重工藝
無論是創新藥還是放制藥,化學藥品新注冊分類申報資料對生產工藝、過程控制、物料控制、關鍵步驟和中間體的控制都有明確的要求,申報資料需包括詳細的研究資料、實驗數據及圖譜,說明在開發階段對哪些工藝步驟以何質量指標進行了工藝條件的優選與放大研究,以充分證明各步工藝均有充足的實驗數據支持,保證現有的研究與生產的規模、物料控制、操作流程及主要設備均已基本與大生產一致,已生產的批數與各批產品的質量均能反映出工藝具備一定的重現性,進而證明該申報工藝的合理性與大生產的可行性。生產工藝表述的詳略程度應能使本專業的技術人員根據申報的生產工藝可以完整地重復生產過程,并制得符合標準的產品。此外,還要求申報時提交工藝開發過程中生產工藝的主要變化(包括批量、設備、工藝參數以及工藝路線等的變化)的詳細說明及相關的支持性驗證研究資料。綜上所述,申報資料的要求越來越接地氣,能生產的才是王道。
申報資料還要求工藝評價要與穩定性試驗和生物等效性試驗結果進行相關分析,要求匯總研發過程中代表性批次(應包括但不限于臨床研究批、中試放大批、生產現場檢查批、工藝驗證批等)的樣品情況,包括:批號、生產時間及地點、批規模、用途(如用于穩定性試驗,用于生物等效性試驗等)、分析結果(例如有關物質、溶出度以及其他主要質量指標)。列表比較臨床試驗/BE試驗樣品的處方工藝、生產設備、批量、關鍵工藝步驟和工藝參數的控制、中間體的控制等與擬定的生產線的異同點,說明這些差異是否影響產品的質量,簡要說明研究情況。
化學藥藥學申報資料還包括輔料申報資料要求和包裝材料/容器申報資料要求,但本次征求意見稿并無一并公布,仍待注冊司統一發布。 |

