8月10日,國家總局發布了《關于藥包材藥用輔料與藥品關聯審評審批有關事項的公告》(以下簡稱“公告”),《公告》提出,簡化藥品審批程序,將直接接觸藥品的包裝材料和容器(以下簡稱藥包材)、藥用輔料由單獨審批改為在審批藥品注冊申請時一并審評審批。  歷史上,藥用輔料引起的諸多不良事件使大家越來越意識到輔料對于藥品關鍵質量的重要性。而仿制藥一致性評價的推進將進一步喚醒政府、相關企業和科研機構對藥用輔料的重視。例如,羥丙甲纖維素(HPMC)是硝苯地平緩釋片的基本骨架材料,但不同廠家生產的HPMC質量存在很大差異,對制劑的體內生物利用度影響巨大。 藥品輔料不良事件 1937年 美國 用二甘醇(diethyleneglycol)替代乙二醇(ethyleneglycol)作溶劑生產磺胺酏劑,造成107人死亡。 1969年 南非 用二甘醇調配鎮靜藥,致7人死亡。 1986年 印度 用二甘醇勾兌藥用甘油,致14人死亡 1990年 尼日利亞 止咳糖漿污染二甘醇致死109人。 1992年 孟加拉 對乙酰氨基酚糖漿中丙二醇污染二甘醇致339人死亡。 1996年 海地 應該用甘油作溶劑生產對乙酰氨基酚糖漿,由于使用了攙假的甘油(含有二甘醇),使用前未經化驗,產品出廠后造成50余名兒童死亡。 2006年 中國 使用含二甘醇的丙二醇生產亮菌甲殼素注射劑致死21人。 2006年 巴拿馬 二甘醇污染用于生產止咳糖漿的甘油致近100人死亡。 2008年 尼日利亞 牙科藥中的丙二醇受二甘醇污染,致死84人。 2012年 中國 用工業明膠生產鉻超標的膠囊。 來源:根據公開資料整理 自2008 年起,我國藥品監管部門就開始致力于改革完善藥用原輔材料管理模式。2008年原國家食品藥品監督管理局起草制定《藥用原輔料材料備案管理規定》,到2012 年正式出臺《加強藥用輔料監督管理有關規定》,藥用輔料管理政策走向漸趨明晰,如今熱議了八年之久的輔料新法規終于落地。而從國際上輔料審批流程的比較來看,藥用輔料與藥品關聯審評審批的做法也并不新鮮。 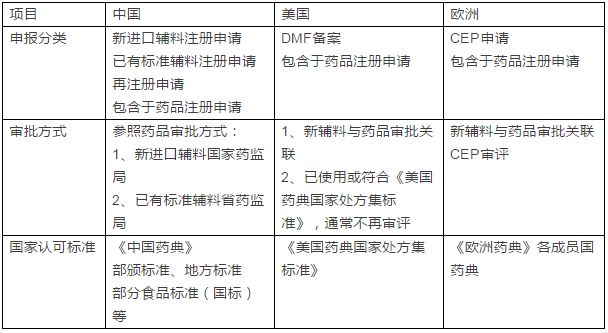 CEP審評:CEP歐洲藥典適用性證書;DMF藥物主文件 DMF全稱Drug Master File,即備案管理,是企業向FDA提供的反映藥品生產和質量管理方面的一整套文件。 如何應對? 制劑企業 樹立責任意識 實施關聯審評審批后,輔料企業提供的資料少了,制劑與輔料相容性、藥理毒理研究由制劑企業提供。這意味著藥企需要樹立對于制劑產品質量負責并溯源的思維,不能只考慮成本,嚴謹選擇藥用輔料,有效掌握藥品生產和上市的使用信息。 加強成本管理 藥企對所購進的藥用輔料生產企業進行質量審計,勢必會增加制劑企業的管理成本。為此,制劑企業需要提升自身的檢驗能力、審計能力,綜合考察輔料企業的生產資格、檢驗標準、質量控制等,加強供應鏈上經銷商、代理商、分包裝商等中間環節的上下級的審計。 創新研發模式 藥用輔料對于制劑成型、穩定、助溶、緩釋、控釋、定向、定時、定位、速效、高效、長效等具有決定作用。優良新輔料的發展可帶動開發藥物新劑型、新工藝,擴展老藥新用路徑,催生制藥行業研發新生態。 輔料企業 加速整合 對于輔料企業而言,藥用輔料與藥品關聯審評審批將拉開整合大幕。目前我國藥用輔料生產的專業化程度低。據統計,全球較具規模的藥輔企業約有200多家,比如德國巴斯夫、美國卡樂康等。而中國僅有90多家專門從事藥用輔料生產的公司,其余多為食品、化工產品生產企業,以“小、散、亂”為特征,集中度低。為此,輔料市場也正面臨著一場“大掃除”,而對于強化質量和安全監管的正規藥用輔料生產企業來說,這無疑是助跑的契機。 專注研發 由于關聯審評審批縮短了注冊周期、提高審批效率、節約審批成本,減小由注冊技術要求存在的差異而造成的重復性研究,輔料企業可以有更多的精力研發輔料特性以滿足用戶的需求。配合脂質體、微球、納米粒等新型載體藥物的輔料開發會有更熱火朝天。 第三方審計機構 第三方審計機構能幫助藥品生產企業及輔料生產企業提高審計效率及輔料產品質量,減少企業因重復審計而造成的審計成本,降低藥品供應鏈風險。藥包材藥用輔料與藥品關聯審評審批是我國實施藥用輔料備案管理制度的關鍵,這種新模式必將培育第三方市場的發展。(生物谷Bioon.com) |

